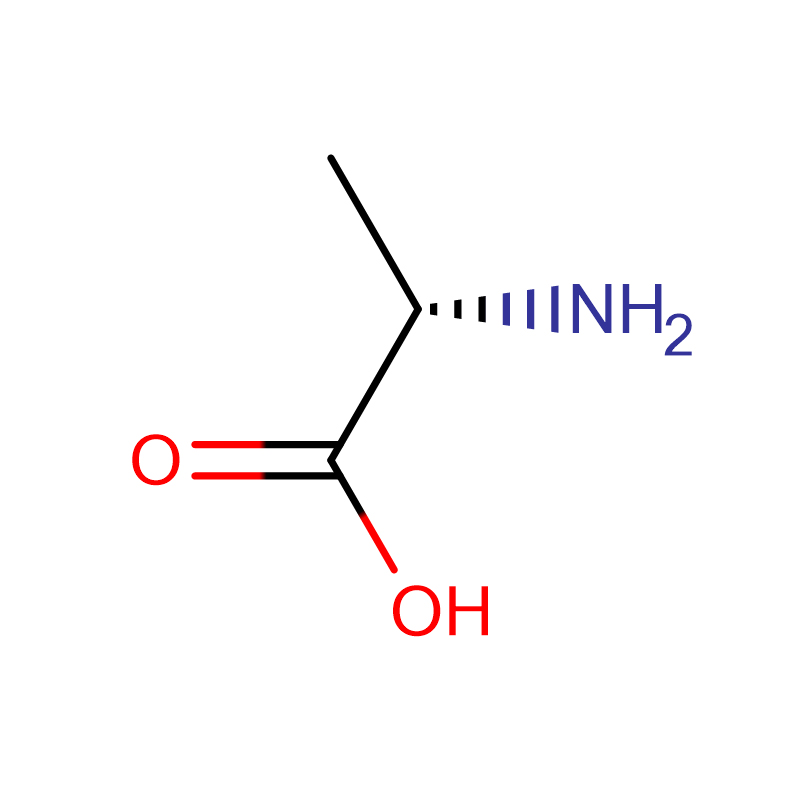
L-аланин CAS:56-41-7 99% бял кристален прах
| Каталожен номер | XD90326 |
| Име на продукта | D-аланин |
| CAS | 338-69-2 |
| Молекулярна формула | C3H7NO2 |
| Молекулно тегло | 89.09 |
| Подробности за съхранение | Околна среда |
| Хармонизиран тарифен код | 29224985 |
Спецификация на продукта
| Външен вид | Бял кристален прах |
| Анализ | 98,5 - 101,5% |
| Специфична ротация | +13,7 до +15,1 |
| Тежки метали | <0,0015% |
| pH | 5,5 - 7 |
| SO4 | <0,03% |
| Загуба при сушене | <0,2% |
| Желязо | <0,003% |
| Остатък при запалване | <0,15% |
| Размер на частиците | 200um |
| Cl | <0,05% |
| Ниво на устойчиви органични замърсители | Без замърсители |
γ-глутамилтранспептидазите (γ-GTs) разцепват γ-глутамил амидната връзка на глутатиона и прехвърлят освободената γ-глутамил група към вода (хидролиза) или акцепторни аминокиселини (транспептидация).Тези вездесъщи ензими играят ключова роля в биосинтезата и разграждането на глутатиона и в ксенобиотичната детоксикация.Тук докладваме кристалната структура с разделителна способност 3Å на Bacillus licheniformis γ-GT (BlGT) и тази на неговия комплекс с l-Glu.Рентгеновите структури потвърждават, че BlGT принадлежи към суперсемейството на N-терминалната нуклеофилна хидролаза и разкриват, че протеинът притежава отворена цепнатина на активното място, подобна на тази, докладвана за хомоложния ензим от Bacillus subtilis, но различна от тези, наблюдавани за човешки γ-GT и за γ-GT от други микроорганизми.Данните предполагат, че свързването на l-Glu индуцира пренареждане на С-терминалната опашка на голяма субединица BlGT и позволява идентифицирането на клъстер от киселинни остатъци, които са потенциално включени в разпознаването на метален йон.Ролята на тези остатъци върху конформационната стабилност на BlGT е изследвана чрез характеризиране на автопроцесирането, ензимната активност, химическата и термичната денатурация на четири нови Ala единични мутанта.Резултатите показват, че заместването на Asp568 с Ala засяга както автообработката, така и структурната стабилност на протеина.