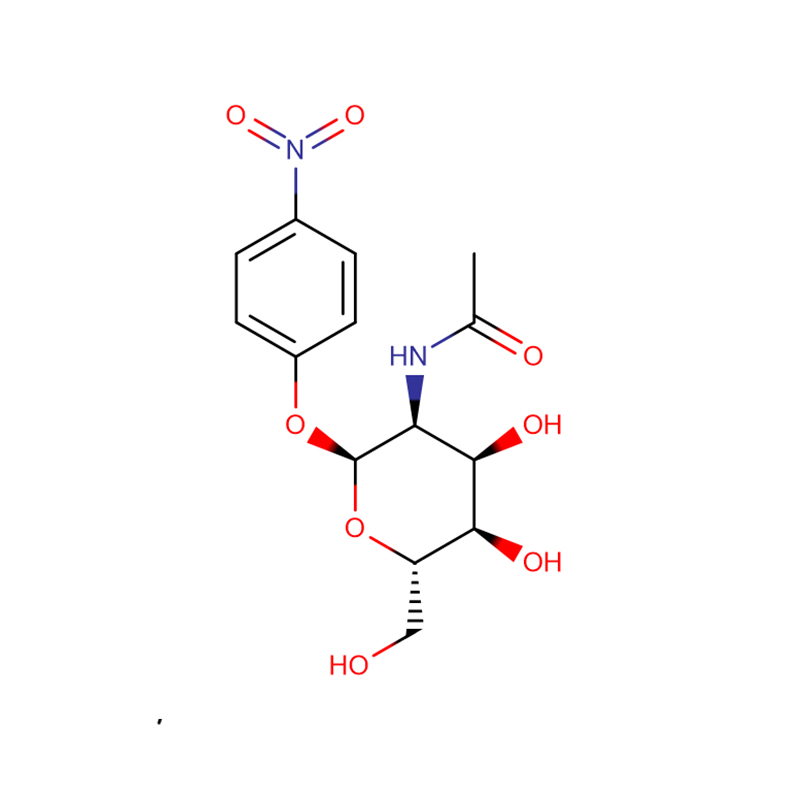
р-нитрофенил -aL-фукопиранозид Cas:10231-84-2 Бял до бледожълт кристален прах
| Каталожен номер | XD90142 |
| Име на продукта | р-нитрофенил -aL-фукопиранозид |
| CAS | 10231-84-2 |
| Молекулярна формула | C12H15NO7 |
| Молекулно тегло | 285.25 |
| Подробности за съхранение | 2 до 8 °C |
| Хармонизиран тарифен код | 29400000 |
Спецификация на продукта
| Външен вид | Бял до бледожълт кристален прах |
| Ассаy | 99% |
| TLC | Единично място |
| Чистота HPLC | Мин. 98% |
| Разтворимост (1% във вода) | Бистър безцветен разтвор |
| Плътност | 1,503±0,06 g/cm3 (20 ºC 760 Torr), |
| Точка на топене | 196-197 ºC |
| Точка на кипене | 515,4°Cat760mmHg |
| Пламна точка | 265,5°С |
| Индекс на пречупване | 1,623 |
LecA (PA-IL) е цитотоксичен лектин и адхезин, произведени от Pseudomonas aeruginosa, който свързва хидрофобните галактозиди с висока специфичност и афинитет.Чрез използване на сливане на lecA-egfp транслация и имуноблот анализ на извънклетъчната матрица на биофилма, ние показваме, че lecA се експресира в клетки, отгледани с биофилм.При статични анализи на биофилм както върху полистирен, така и върху неръждаема стомана, дълбочината на биофилма и повърхностното покритие бяха намалени чрез мутация на lecA и подобрени в LecA-свръхпродуциращия щам PAO-P47.Покриването на повърхността на биофилм от родителския щам, PAO-P47, но не и lecA мутанта върху стоманени купони, също беше инхибирано от растеж в присъствието на изопропил-бета-D-тиогалактозид (IPTG) или р-нитрофенил-алфа-D-галактозид ( NPG).Освен това, зрели биофилми от див тип, образувани в отсъствието на тези хидрофобни галактозиди, могат да бъдат диспергирани чрез добавяне на IPTG.Обратно, добавянето на р-нитрофенил-алфа-L-фукоза (NPF), която има висок афинитет към P. aeruginosa LecB (PA-IIL) лектин, няма ефект върху образуването или разпръскването на биофилм.Планктонният растеж на P. aeruginosa PAO1 не се повлиява от присъствието на IPTG, NPG или NPF, нито щамът е в състояние да използва тези захари като източници на въглерод, което предполага, че наблюдаваните ефекти върху образуването на биофилм се дължат на конкурентното инхибиране на LecA-лиганда подвързване.Подобни резултати бяха получени и за биофилми, отглеждани при условия на динамичен поток върху стоманени купони, което предполага, че LecA допринася за архитектурата на биофилма на P. aeruginosa при различни условия на околната среда.
Алфа-L-фукозидаза (EC 3.2.1.51), способна да освободи t-фукозилния остатък от страничната верига на ксилоглюкановите олигозахариди, е открита в листата на растения Arabidopsis.Освен това, алфа-L-фукозидаза с подобна субстратна специфичност беше пречистена от листата на зеле (Brassica oleracea), за да се направи единична лента на SDS-PAGE.Две пептидни последователности бяха получени от тази протеинова лента и те бяха използвани за идентифициране на ген на Arabidopsis, кодиращ алфа-фукозидаза, която предлагаме да наречем AtFXG1.Освен това беше открит и ген на Arabidopsis с хомология с известни алфа-L-фукозидази и ние предложихме да го наречем AtFUC1.Както AtFXG1, така и ATFUC1 бяха хетероложно експресирани в клетки на Pichia pastoris и алфа-L-фукозидазните активности, секретирани в културалната среда.Алфа-L-фукозидазата, кодирана от AtFXG1, е активна срещу олигозахаридите от ксилоглюкан XXFG, както и срещу 2'-фукозил-лактитол, но не и срещу р-нитрофенил-алфа-L-фукопиранозид.Въпреки това хетероложно експресираният AtFUC1 е активен само срещу 2'-фукозил-лактитол.Следователно първото трябва да е свързано с метаболизма на ксилоглюкан.