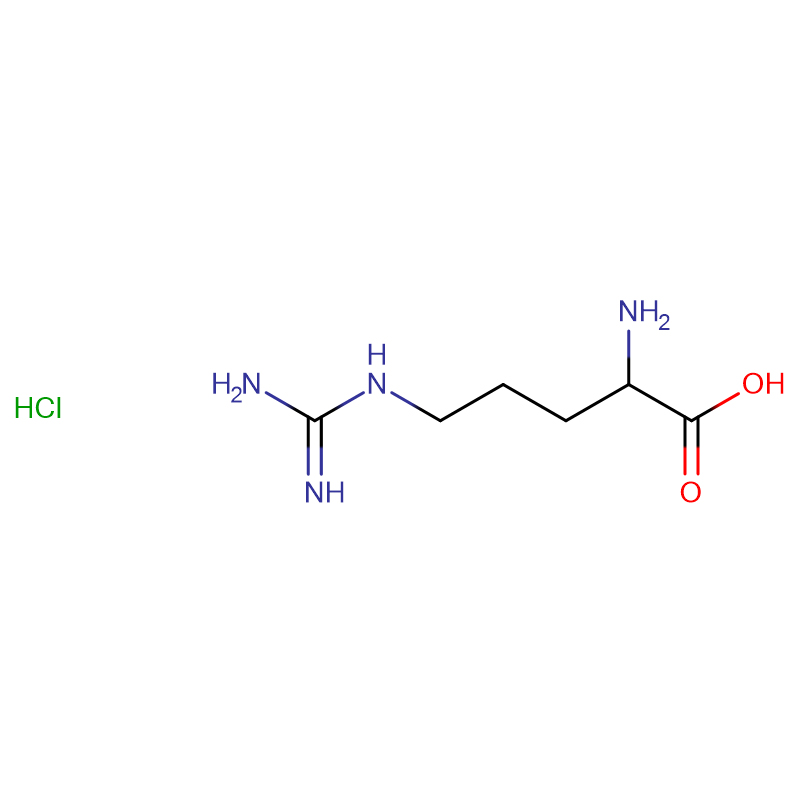
L-аргинин CAS:74-79-3 99% бели кристали или кристален прах
| Каталожен номер | XD90323 |
| Име на продукта | L-аргинин |
| CAS | 74-79-3 |
| Молекулярна формула | C6H14N4O2 |
| Молекулно тегло | 174.20 |
| Подробности за съхранение | Околна среда |
| Хармонизиран тарифен код | 29252900 |
Спецификация на продукта
| Външен вид | Бели кристали или кристален прах |
| Анализ | 99% |
| Идентификация | Инфрачервена абсорбция |
| Загуба при сушене | ≤ 0,5% |
| Хроматографска чистота | Намерени са не повече от 0,5% от всеки отделен примес ; Открити са не повече от 2,0% от общите примеси |
| Остатък при запалване | ≤ 0,3% |
| Тежки метали (PB) | ≤ 0,0015% |
| Желязо (като Fe) | ≤ 0,003% |
| Сулфат (като SO4) | ≤ 0,03% |
| USP степен | USP 33 |
| Хлорид (CI) | ≤ 0,05% |
| Специфична ротация [ α ] D 2 5 | +26,3° ~ +27,7° |
Механизмът на Mycobacterium smegmatis G (MbsG), флавин-зависима l-лизин монооксигеназа, беше изследван при стационарни и бързи реакционни условия, като се използват първични и кинетични изотопни ефекти на разтворителя, субстратни аналози, рН и ефекти на вискозитета на разтворителя като механични проби.Резултатите предполагат, че l-лизинът се свързва преди NAD(P)H, което води до намаляване на константата на скоростта за редукция на флавин.Свързването на l-лизин няма ефект върху скоростта на окисление на флавин, което се случва в едноетапен процес без наблюдение на C4a-хидропероксифлавин междинен продукт.Подобни ефекти бяха определени с няколко субстратни аналози.Окислението на флавин е независимо от pH, докато kcat/Km и kred/KD pH профилите за NAD(P)H показват единични стойности на pKa от ~6,0, с нарастваща активност с намаляването на pH.При по-ниско pH, ензимът става по-несвързан, произвеждайки повече водороден пероксид и супероксид.Преносът на хидрид е частично ограничаващ скоростта при неутрално pH и става по-ограничаващ скоростта при ниско pH.Обратен ефект на вискозитета на разтворителя върху kcat/Km за NAD(P)H се наблюдава при неутрално рН, докато нормален ефект на вискозитета на разтворителя се наблюдава при по-ниско рН.Заедно резултатите показват уникален механизъм, при който настъпва ограничаваща скоростта и чувствителна към рН конформационна промяна в редуктивната полуреакция, която влияе върху ефективността на лизин хидроксилирането.